Az egyensúlynál az előre- és a visszirányú reakciók sebessége egyenlő. Ez azt jelenti, hogy több termékkel rendelkezhet, mint reagenssel, vagy több, mint a termékkel. Ez csak azt jelenti, hogy mindegyik képződési sebessége egyenlő, és így nincs nettó változás az egyes mennyiségben. Az egyensúlyban lévő termékek és reagensek mennyisége előnyben részesíthető, mennyiségük nem változik, ha elérik az egyensúlyt.
A hőmérséklet és a nyomás függvényében a rendszer egyensúlyi összetétele megváltozhat.
Emlékezzünk vissza, hogy a $$ \ ce {aA + bB< = >cC + dD} $$
reakcióban az egyensúlyi állandó : $$ K = \ frac {[\ ce {C}] ^ c [\ ce {D}] ^ d} {[\ ce {A}] ^ a [\ ce {B}] ^ b} $$ Ezek a koncentrációk a $ \ ce {A} $ és a $ \ ce {B} $ egyensúlyban van .
Ezért olyan helyzetben, amikor $ \ ce {A< = >B} $ és $ \ Delta G_ \ mathrm {r} ^ \ circ \ lt0 $ , majd $ K>1 $ , vagyis több $ \ ce {B} $ található, mint $ \ ce {A} $ egyensúlyban (és fordítva).
Ha érdekli, miért $ \ Delta G_ \ mathrm {r} ^ \ circ = -RT \ ln K $ adja meg a reakció Gibbs-energiájának standard változását, akkor vegye figyelembe, hogy az egyenlet általános formája a A reakciót $$ \ Delta G_ \ mathrm {r} = \ Delta G_ \ mathrm {r} ^ \ circ + RT \ ln Q $$ p adja meg >
Hol $ Q = \ frac {[\ ce {C}] ^ c [\ ce {D}] ^ d} {[\ ce {A}] ^ a [ \ ce {B}] ^ b} $ a reakció bármely pontján. Az egyensúlynál nincs több Gibbs-mentes energia, mivel a rendszer már nem hajlamos a termékek vagy a reagensek képződésére. Ezért ezen a ponton $ \ Delta G_ \ mathrm {r} = 0 $ , és az Atkins-ben megadott eredeti kifejezés az, amit kap. Meghatározzuk a $ Q $ speciális esetét is, mondván, hogy az equlibrium $ Q = K $ egyensúlyi állandó.
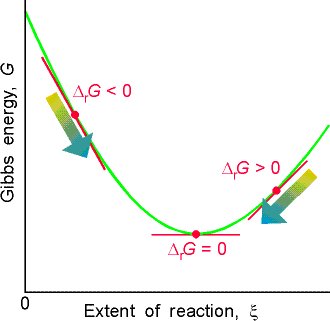 Forrás
Forrás
A fenti kép hasznos lehet. Az y tengely a Gibbs szabad energia mennyiségét mutatja, $ G $ . A reakció arra az állapotra akar majd hajlamosítani, ahol a legalacsonyabb a Gibbs-féle szabad energia (a helyi minimum). A görbe meredeksége ezért $ \ Delta G_ \ mathrm {r} $ . Ezért az a pont lesz, ahol a rendszer a legkevesebb Gibbs-energiával rendelkezik, amikor a $ \ Delta G_ \ mathrm {r} = 0 $ a reakció mértékének bárhol bekövetkezhet. Ez azt mutatja, hogy az egyensúlyi koncentrációnak nem kell egyenlőnek lennie, de azt mutatja, hogy a reakció nem halad tovább, ha $ \ Delta G_ \ mathrm {r} = 0 $ .